肺がんの薬物療法
Q.非小細胞肺がんではどのような薬物療法が行われますか
A.非小細胞肺がんの薬物療法には、殺細胞性抗がん剤を用いた化学療法、分子標的薬を用いた分子標的治療、免疫療法があります。
がんの再発・転移を防ぐために、手術や放射線療法と組み合わせて、あるいは単独で行われます。
非小細胞肺がんの薬物療法は、Ⅲ期以降、手術による根治が難しい段階になってから単
独で、あるいは再発・転移を防ぐために放射線療法と組み合わせて(化学放射線療法)行われるほか、手術で根治が可能なⅠ~Ⅱ(ときにⅢA)期の術後に、残っている可能性がある目に見えないがん細胞を根絶し、再発を防ぐために術後補助化学療法として行われることもあります。
術後補助化学療法ではシスプラチン併用療法や、日本ではIA期の一部とⅠB期の場合、経口抗がん剤のテガフール・ウラシル配合剤を1~2年間、毎日服用する方法が有効とされています。
個別化が進む薬物療法
Ⅲ期以降に治療の主体となってくる薬物療法には、
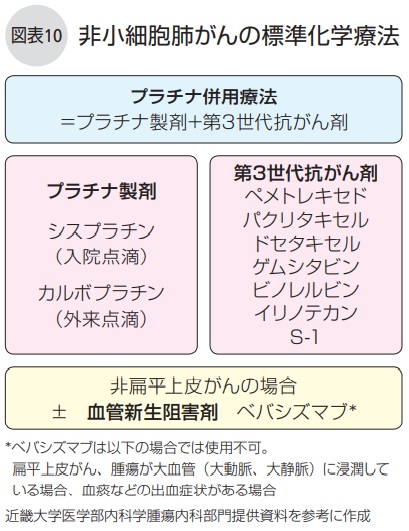
①抗がん剤によってがんの増殖を抑え、がん細胞を破壊する化学療法(図表10)、
②がん細胞だけが特異的に持つ生存・増殖に関与する物質を標的にした分子標的治療、
③がん細胞が生存・増殖するために持っている生体の免疫反応(病気を引き起こす細菌やウイルス、がん細胞などの異物から身体を守る仕組みの総称)を回避するシステムをチェックポイントとなる分子でピンポイントに阻害し、免疫系を活性化させてがん細胞を攻撃・破壊する免疫チェックポイント阻害療法
があります。
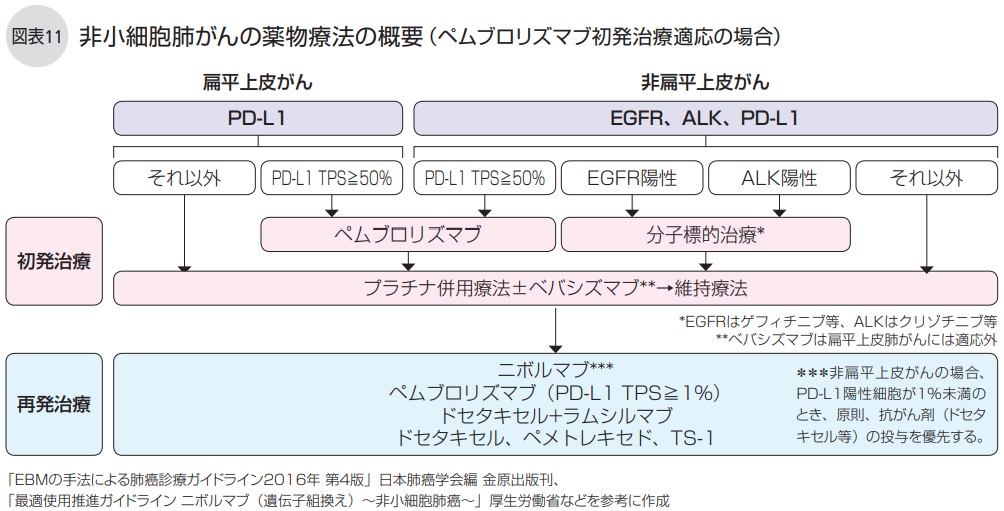
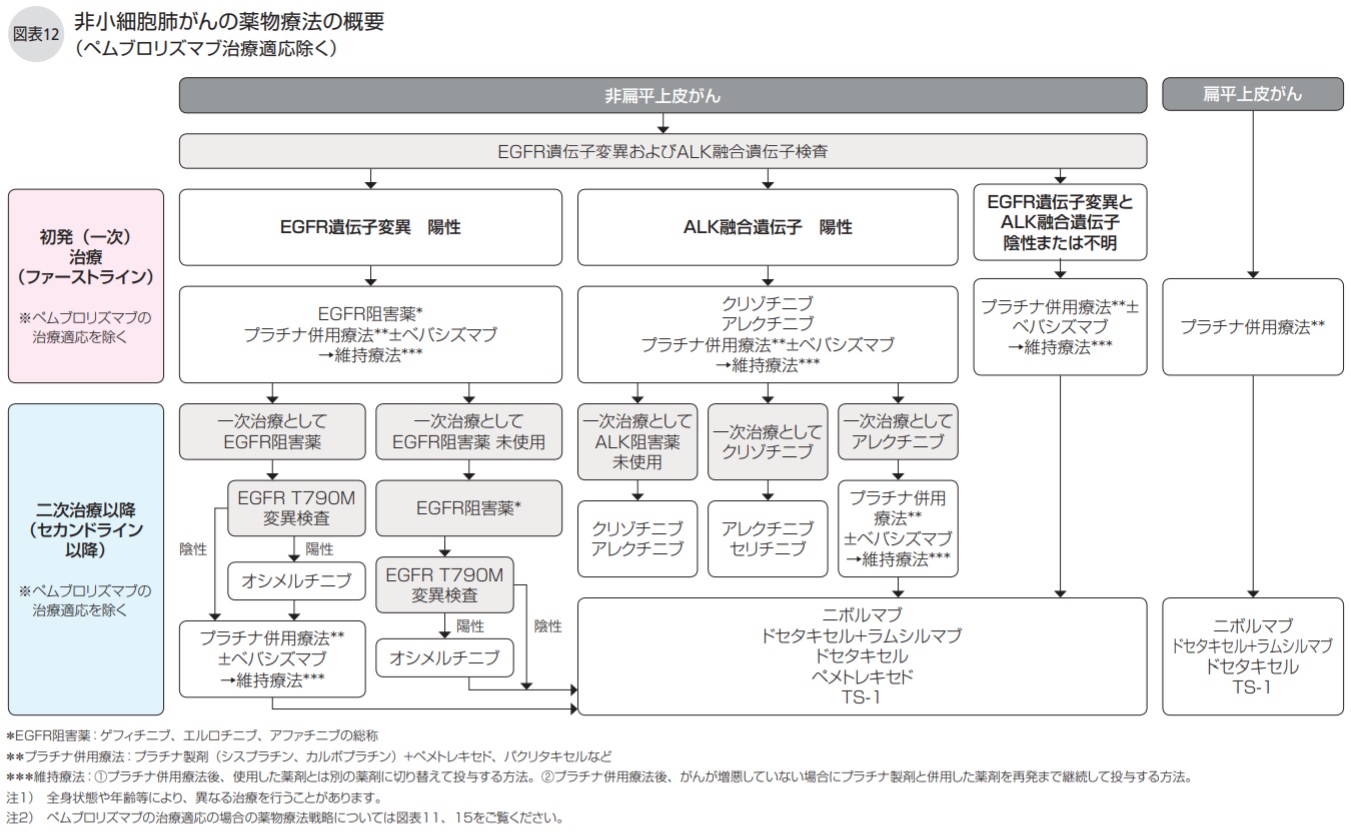
これらの薬剤や治療法をどのように使うかの戦略は、組織型、チェックポイントとなる分子の発現量、および遺伝子変異の有無で分けられ(図表11、12)、治療レジメン(時系列的な治療計画書)は薬剤の副作用や程度、PS(全身状態の指標)などを考慮して選択されます。
扁平上皮がん
扁平上皮がんでは、初発(1次)治療として、採取した腫瘍におけるPD-L1発現量が十分(PD-L1陽性細胞が50%以上)であればペムブロリズマブを、そうでなければプラチナ併用療法を実施します。
再発すれば、前者ではプラチナ併用療法を、後者ではニボルマブ、ペムブロリズマブ(PD-L1陽性細胞が1%以上)、ドセタキセル±ラムシルマブなどを試みます。
なお、プラチナ併用療法では脱毛や吐き気の副作用が強く出現します。
入院点滴が必要なシスプラチンより外来点滴が可能なカルボプラチンが選択されることが多くなっています。
第3世代抗がん剤は一度使用すると次の段階ではあまり使わないため、たとえばゲムシタビンを初発治療で用いると再発以降では別の薬剤を用います。
非扁平上皮がん
非扁平上皮がんで遺伝子変異陰性の場合の初発治療は、PD-L1陽性細胞が50%以上であればペムブロリズマブを、そうでなければプラチナ併用療法、あるいは全身状態に応じてプラチナ併用療法に血管新生阻害剤のベバシズマブを併用する3剤併用療法を行います。
再発したときは、前者ではプラチナ併用療法±ベバシズマブを、後者ではニボルマブ、ペムブロリズマブ(PD-L1陽性細胞が1%以上)、ドセタキセル±ラムシルマブ、ペメトレキセドなどを試みます。
非扁平上皮がんで遺伝子変異陽性の場合は、初発治療として分子標的治療(EGFR阻害薬、ALK阻害薬)か、プラチナ併用療法±ベバシズマブのいずれかを行いますが、一般的には、間質性肺炎のリスクがかなり高いなどを除き、初発の段階で分子標的治療が行われることが多くなっています。
再発したときは、PD-L1陽性細胞の発現の割合や、EGFR阻害剤を初発治療で使用した場合ではT 790M変異があるかないかなどを考慮して、初発治療で行った治療とは別の治療を試みます。
副作用には早めに対応
個人差はあるものの、抗がん剤を投与した当日より治療が進むにつれ、アレルギー反応、脱毛、吐き気・嘔吐、食欲不振、下痢、口内炎、白血球や血小板の減少など、さまざまな副作用が現れます。
副作用を抑える薬剤を併用したり、早めに対応したりすることで軽減できますが、副作用が強くなれば、抗がん剤を減量・中止せざるを得なくなります。
よりよい状態で長く生きるためには、標準治療を予定どおり継続していくことが重要です。
副作用やつらい症状があれば遠慮せずに担当医や看護師、薬剤師に早めに申し出て、副作用を軽減する治療や緩和治療を受けましょう。
より個別化した最適な治療を行うためにバイオマーカーを用いた検査が行われます
バイオマーカーとは、病気の変化や治療に対する反応をみる客観的な指標になりうる体内の物質のことで、血液、唾液、尿などの体液やがん細胞、組織などに含まれるタンパク、遺伝子などがあります。
現在、がん診療で実際に使われているバイオマーカーの多くは、薬物療法の治療方針を決めるために、特定の薬剤の治療効果をあらかじめ予測するマーカー(以下、効果予測マーカー)です。
これまでがんの薬物療法は臓器別にほぼ同じ治療が行われていましたが、近年では効果予測マーカーを調べることにより治療効果を得られる可能性が高いとわかっている人だけに薬を投与できるようになったので、患者さんのがんのタイプに合わせ、最も治療効果の高い薬物療法を選択する「個別化治療」が行われるようになっています。
非小細胞肺がんの個別化治療
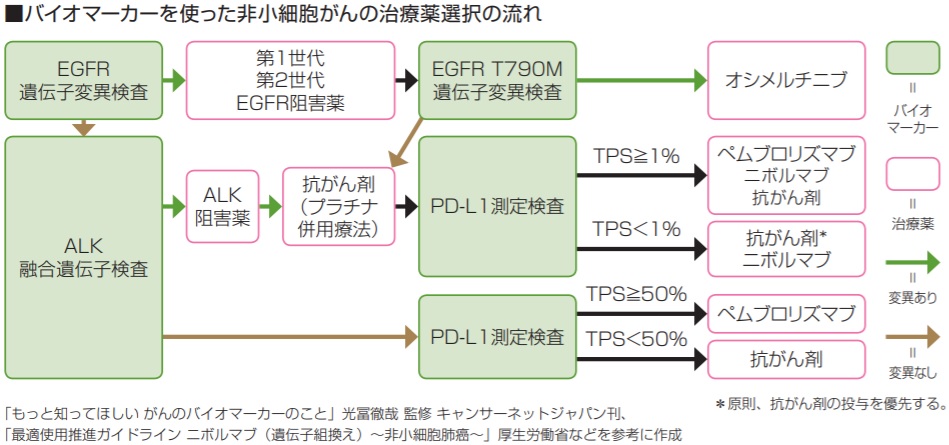
非小細胞肺がんの効果予測マーカーには、がん細胞が出すタンパクのPD-L1のほか、非扁平上皮がんでは上皮成長因子受容体HER1(EGFR)遺伝子変異、EGFR T790M遺伝子変異、未分化リンパ腫キナーゼ(ALK)融合遺伝子、ROS1融合遺伝子があります。
日本肺癌学会が作成した「肺癌診療ガイドライン」では、これらの効果予測マーカーを調べたうえで、治療法を選択することを推奨しています。
検査は、薬物療法開始前に、がんの確定診断の際などに実施する生検(針やメスで組織を採取する検査法)や手術で採取したがん組織の一部を用いて調べます。
EGFR T790M遺伝子変異は、治療に使っていた薬の効果が得られなくなったときや進行・再発したときにも、再度、気管支鏡などを用いてがん組織を採取(再生検)して調べます。
また、この遺伝子変異は血液で調べられるようになり、患者さんの負担軽減が期待されています。
非扁平上皮がんでEGFR遺伝子変異が陽性であれば、第1、2世代のEGFR阻害薬が第一選択となり、その治療効果がなくなれば再生検によりEGFR T790M遺伝子変異を調べ、陽性の場合には第3世代のEGFR阻害薬を使います。
ALK融合遺伝子が陽性であれば、ALK阻害薬を使います。
一方、EGFR遺伝子変異もALK融合遺伝子も陰性の場合や扁平上皮がんでは、PD-L1の発現量を測定し、50%以上であれば免疫チェックポイント阻害薬のペムブロリズマブを試み、それ以外には従来の抗がん剤治療が行われます。
また、非扁平上皮がんで、EGFR遺伝子変異陽性、ALK融合遺伝子陽性の場合も現時点で使用できるEGFR阻害薬、ALK阻害薬がないときは、PD-L1陽性細胞を測定し、PD-L1陽性細胞が1%以上であればペムブロリズマブを含め、1%以下であればそれを含めず、ニボルマブあるいは従来の抗がん剤の投与を検討します。
参考資料
もっと知ってほしい肺がんのこと 2017年版,pp.12-14





























